
Leistungskurs CH-1 2012
Kursleitung: Herr Ecker
Die Konzentrationszelle
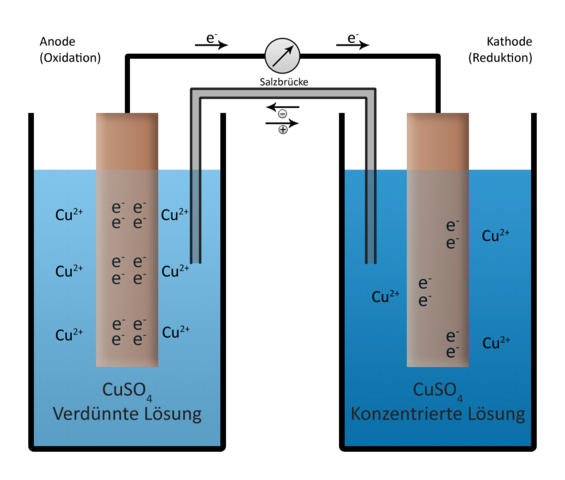
Diese Zelle basiert auf zwei gleichen Halbzellen die unterschiedliche Konzentrationen der Lösungen besitzen. Beim Anschluss eines Voltmeters stellt man eine Spannung fest. Die Spannung ist vom Konzentrationsunterschied abhängig. Ein Versuchsaufbau mit einer Konzentration von 0,01mol/l in der einen Halbzelle und von 1mol/l in der anderen liefert eine Spannung von 0,059V. Dabei ist die Halbzelle mit der geringeren Konzentration die Anode, d. h. dort findet die Oxidation statt und die andere Halbzelle ist die Kathode an der die Reduktion stattfindet. Beim Schließen des Stromkreises fließen die Elektronen von der Anode zur Kathode. Die Halbzelle mit der verdünnten Lösung ist also die Donatorhalbzelle und die mit der höheren Konzentration die Akzeptorhalbzelle.
Der deutsche Physiker und Chemiker Walter Nernst leitete 1889 eine Gleichung her mit deren Hilfe man diese Spannung berechnen kann. Sie wird Nernst'sche Gleichung für die Konzentrationszelle genannt: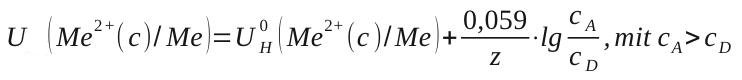
In der Formel wird der dekadische Logarithmus verwendet, der auf Taschenrechnern meist mit log bezeichnet wird.
Aufgabe:
Überprüfen Sie anhand der obigen Konzentrationen der beiden Halbzellen die angegebene Spannung!
Lösung
Die allgemeine Nernst'sche Gleichung, mit der die Spannungen aller Zellen berechnet werden können lautet:
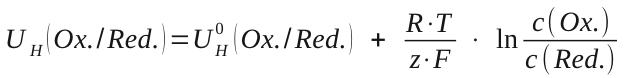
Aufgabe:
Zeigen Sie, dass die die Gleichung für die Konzentrationshalbzelle aus aus der allgemeinen hergeleitet werden kann. Suchen Sie dazu im Lehrbuch oder im Internet die folgende Konstanten heraus: R allgemeine Gaskonstante, T Temperatur bei Standardbedingungen in Kelvin und F die Faradaykonstante. Das kleine z in der Formel ist die Anzahl der pro Formelumsatz ausgetauschten Elektronen.
Hinweis es muss der natürliche Logarithmus in den dekadischen umgewandelt werden.
Lösung