Konzentrationszelle
Geräte und Chemikalien:
Voltmeter (Digitalmultimeter), Kupferelektroden, Schleifpapier, Kupfersulfatlösungen mit c=0,1 mol/l und c=0,001 mol/l, Kaliumchlorid (1 mol/l), Kabel, Uhrglas, Becherglas, Strombrücke.
Versuchsaufbau:
Versuchsdurchführung:
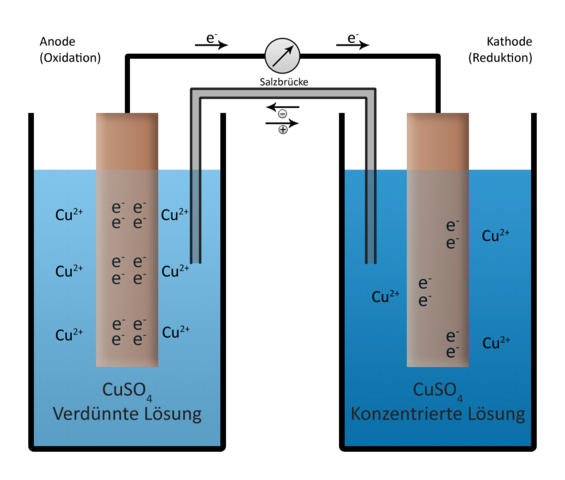
Durchführung: Die zwei verschieden konzentrierten Kupfersulfatlösungen werden jeweils mit einer frisch abgeschliffenen Kupferelektrode in ein Becherglas getan. Die Kupferelektroden werden mit dem Digitalmultimeter verbunden und eine in Kaliumchloridlösung getränkte Strombrücke verbindet die zwei Elektrolytlösungen.
Versuchsbeobachtung:
Die gemessene Spannung beträgt anfangs 52 mV bis sie schließlich nur noch
39 mV beträgt.
Der Pluspol ist die Kupferelektrode in der stärker konzentrierten Lösung und
der Minuspol die Kupferelektrode in der niedriger konzentrierten Lösung.
Versuchserklärung:
An der Kupferelektrode in der 0,1-molaren Lösung, also der mit der stärkeren
Konzentration, können nicht viele Kupfer-(II)-Ionen oxidiert werden
(in die Lösung gehen), weil es dort einen Überschuss an Kupfer-(II)-Ionen gibt.
Die überschüssigen Kupfer-(II)-Ionen bilden an der Kupferelektrode eine
Schicht, sodass keine oder nur wenige Kupferatome in Lösung gehen können.
So entsteht ein Elektronenmangel an dieser Elektrode.
Die Kupferelektrode in der verdünnten 0,001-molaren Lösung,
gibt im Vergleich dazu mehr Kupfer-(II)-Ionen in die Lösung ab. Weil sich in
dieser Lösung weniger Kupfer-(II)-Ionen befinden und es noch eine Menge Platz
für die Kupfer-(II)-Ionen gibt, können mehr Kupferatome ihre Elektronen abgeben
und so in Lösung gehen. Daraus folgt, dass an dieser Kupferelektrode ein
Elektronenüberschuss herrscht.
Eigentlich sind beide Kupfer-Halbzellen negativ geladen aber da die eine Kupfer-Halbzelle gegenüber der anderen Kupfer-Halbzelle negativer geladen ist, wird sie als Anode bezeichnet, da dort die Oxidation stattfindet. Zwischen den beiden Elektroden lässt sich deshalb eine Spannung mit einem Voltmeter messen.
Bei der Verbindung der beiden Elektroden über einen Stromkreis fließen Elektronen vom Minuspol zum Pluspol, an dem dann die Reduktion stattfindet. Es fließt also ein Strom.
Die Spannung der Konzentrationszelle lässt sich mit Hilfe der Nernst'schen Gleichung berechnen:
A ist dabei die Konzentraion der Halbzelle in der die Oxidation abläuft und B die Konzentration der Halbzelle in der die Reduktion abläuft.
Es ergibt sich also eingesetzt:
Der berechnte Wert beträgt 0,059V. Der gemssene Wert betrug 0,052V.
Erstellt von Stefan und Farid, mit Ergänzungen durch Herrn Ecker. 7.1.2016