
Von der Kettenform zur Ringform
Durch intramolekulare
nucleophile
Addition einer Hydroxylgruppe
an eine Carbonylgruppe kommt es zur Bildung eines Halbacetals.
1.Schritt:
Die Hydroxylgruppe des 5. Kohlenstoffatoms dreht sich so,
dass sie in nach unten gerichtet ist.
2. Schritt:
Die Einfachbindungen zwischen den Kohlenstoffatomen sind frei drehbar,
sodass das Glucosemolekül einen Ring bilden kann.
Je nachdem wie die Carbonylgruppe an dem C-1-Atom ausgerichtet ist,
entstehen am Ende zwei verschiedene D-Glucose-arten.
3.Schritt: (Das Sauerstoffatom ist an der Carbonylgruppe nach oben gerichtet)
Das 1. Kohlenstoffatom ist wegen der Carbonylgruppe partiell positiv geladen.
An dieser Stelle erfolgt der Angriff des negativierten Sauerstoffatoms der
Hydroxylgruppe (nucleophiler Angriff).
Das nichtbindende Elektronenpaar an dem Sauerstoffatom in der Hydroxylgruppe
bindet sich mit dem C-1-Atom und formt somit ein 6-Ring. Das Sauerstoffatom
besitzt somit eine positive Ladung.
Die Doppelbindung an dem C-1-Atom wird zu einer Einfachbindung aufgelöst.
Dabei klappt das nichtbindende Elektronenpaar zum Sauerstoffatom, sodass
dieses Sauerstoffatom negativ geladen ist.
4.Schritt:
Das positiv geladene Sauerstoffatom zieht das Elektron des Wasserstoffs an,
so dass ein Proton entsteht.
Das Proton wird vom negativ geladenen Sauerstoffatom von der
Carbonylgruppe angezogen und gebunden.
Am Ende ensteht ein Halbacetal.
Def.:
Man nennt chemische Verbindungen Halbacetale,
wenn ein Alkylrest über ein Sauerstoffatom mit einem Kohlenstoffatom verbunden
ist, an dem außerdem noch eine Hydroxylgruppe gebunden ist.
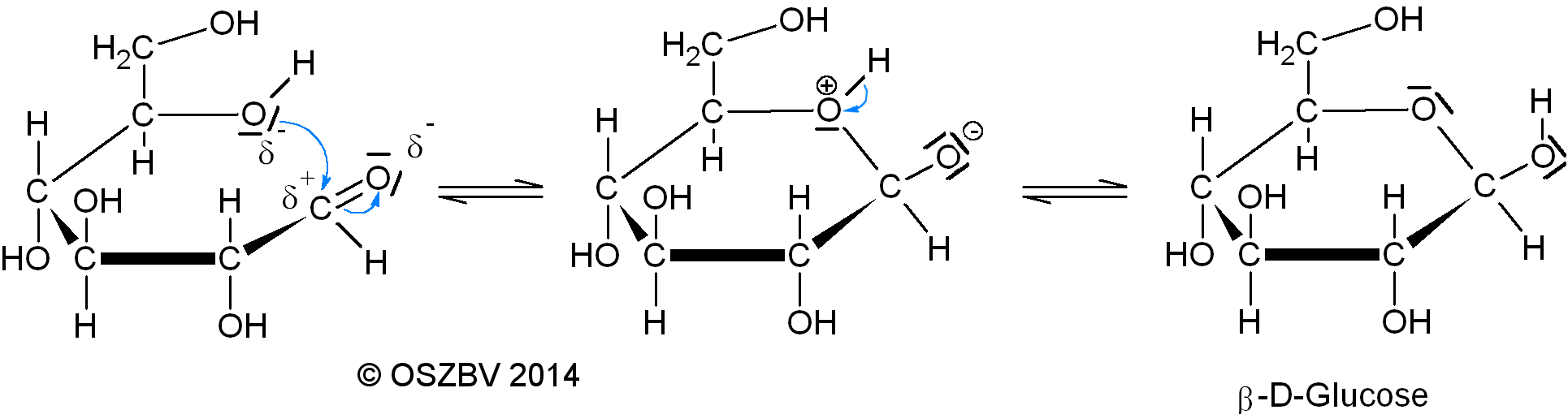
Ringschluss der Glucose
Analog gilt die Reaktion auch für die Carbonylgruppe, wo das Sauerstoffatom unten ausgerichtet ist. Das C-1-Atom ist ein chirales Zentrum, das bedeutet, dass die räumliche Anordnung der Substituenten an diesem Kohlenstoffatom zu zwei verschiedenen räumlichen Molekülen des D-Glucosemoleküls führt. Glucose bildet dabei bevorzugt cyclische sechsgliedrige Ringe ( 6-Ringzucker heißen Pyranosen). Wenn die Hydroxylgruppe nach oben gerichtet ist, nennt man das Glucosemolekül β-D-Glucose und wenn die Hydroxylgruppe nach unten gerichtet ist, dann nennt man es α-D-Glucose.
Beide Formen zeigen unterschiedliche optische Aktivitäten.
Text von A.N. mit kleinen Ergänzungen von Herrn Ecker 2.9.2014
Keto-Enol-Tautomerie der Fructose
Problem:
Obwohl bei der Fructose nur eine Ketogruppe und keine Carbonylgruppe vorliegen war die Fehling'sche Probe positiv verlaufen. Die Schiff'sche Probe in saurer Umgebung verlief erwartungsgemäß negativ.
Lösung:
Die Fehlingsche Probe verläuft in alkalischer Umgebung, wodurch eine Reaktion ermöglicht wird, der Keto-Enol-Tautomerie genannt wird.
Bei dieser Reaktion wird durch intramolekulare Umlagerung eine Ketogruppe über
einen Zwischenschritt in eine Carbonylgruppe umgewandelt.
Diese Reaktion wird durch Hydroxydionen katalysiert.
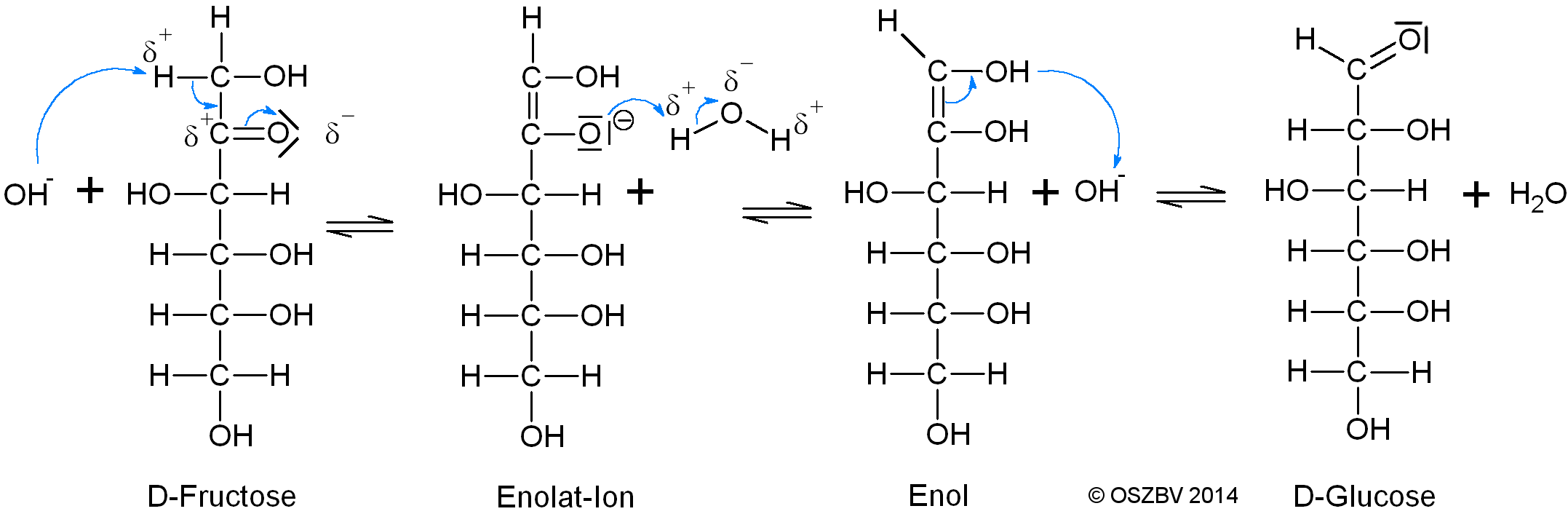
Keto-Enol-Tautomerie bei Fructose
Es fehlt noch die ganze Beschreibung des Reaktionsmechanismus!