
Bestimmung des Äquivalenzpunktes von Essigsäure
Hier wir der Äquivalenzpunkt der Essigsäure einer schwachen Säure bestimmt.
Geräte und Chemikalien:
0,1 molare Essigsäure, Maßlösung 0,1 molare Natronlauge, Bürette, Stativ,
Becherglas, Magnetrührer, geeichtes pH-Meter
Vorbereitung der Chemikalien:
Hier muss beschrieben werden, wie die Chemikalien zubereitet wurden.
Versuchsaufbau:
Foto!
Versuchsdurchführung:
Was wurde genau gemacht, worauf musste geachtet werden?
Versuchsbeobachtung:
Was wurde beobachtet?
Versuchsauswertung:
V/ml | pH | V/ml | pH | V/ml | pH |
0 | 3,03 | 20 | 5,00 | 40 | 12,09 |
1 | 3,43 | 21 | 5,06 | 41 | 12,13 |
2 | 3,81 | 22 | 5,13 | 42 | 12,17 |
3 | 3,83 | 23 | 5,21 | 43 | 12,21 |
4 | 3,96 | 24 | 5,28 | 44 | 12,25 |
5 | 4,03 | 25 | 5,38 | 45 | 12,28 |
6 | 4,12 | 26 | 5,47 | 46 | 12,31 |
7 | 4,20 | 27 | 5,59 | 47 | 12,34 |
8 | 4,28 | 28 | 5,73 | 48 | 12,36 |
9 | 4,34 | 29 | 5,93 | 49 | 12,38 |
10 | 4,41 | 30 | 6,31 | 50 | 12,40 |
11 | 4,47 | 31 | fehlt | ||
12 | 4,54 | 32 | 11,01 | ||
13 | 4,60 | 33 | 11,38 | ||
14 | 4,65 | 34 | 11,62 | ||
15 | 4,70 | 35 | 11,71 | ||
16 | 4,77 | 36 | 11,83 | ||
17 | 4,82 | 37 | 11,91 | ||
18 | 4,87 | 38 | 11,99 | ||
19 | 4,94 | 39 | 12,04 |
Grafik:
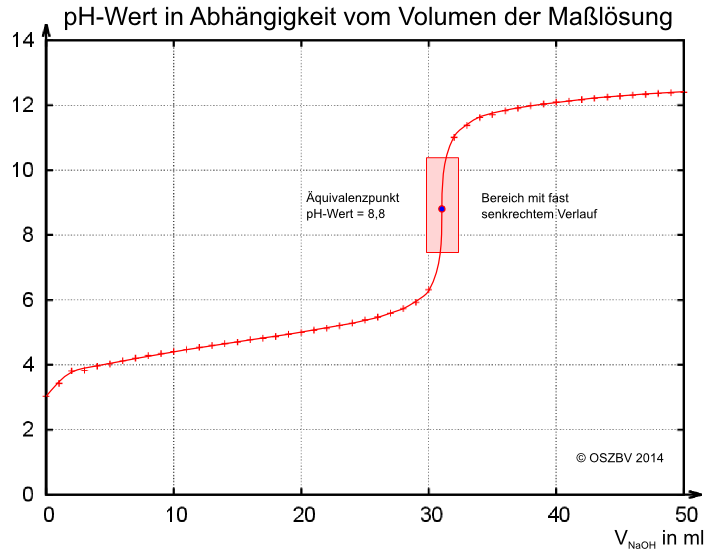
Definition des Äquivalenzpunktes:
Der Äquivalenzpunkt ist der Wendepunkt der Kurve in dem senkrechten Kurvenbereich. Am Äquivalenzpunkt liegen gleiche Stoffmengen an Säure und Base vor.
Genaue Bestimmung des Äquivalenzpunktes mit der 3-Geraden-Methode:
Es wird eine Tangente an die untere Krümmumg der Kurve und parallel dazu auch an die obere Krümmumg der Kurve gezeichnet. Danach wird eine Senkrechte durch beide Tangenten gezeichnet und anschließend in der Mitte noch eine Parallele Gerade. Der Schnittpunkt dieser Gerade ist dann der Äquivalenzpunkt.