
Bestimmung des Äquivalenzpunktes der Neutralistion
Heute wird mit einem pH-Meter die Änderung des pH-Werts während der Titration
genau gemessen. Dazu titrieren wir eine Salzsäurelösung nicht genau bekannter
Konzentration. Außerdem soll der Äquivalenzpunkt bestimmt werden. Das ist der
Punkt der Titration, bei dem genau gleiche Stoffmengen
in der Lösung vorhanden sind.
Geräte und Chemikalien:
Salzsäure unbekannter Konzentration, Maßlösung 0,1 molare Natronlauge,
Bürette, Stativ, Becherglas, Magnetrührer, pH-Meter
Versuchsaufbau:

Versuchsdurchführung:
50ml Maßlösung werden in die Bürette gefüllt. Die Säure wird in das Becherglas gegeben und das pH-Meter sowie der Magnetrührer eingeschaltet und der erste Messwert wird abgelesen. Anschließend wird in 1ml-Schritten Maßlösung zugegegen und jeweils der pH-Wert abgelesen.
Versuchsbeobachtung:
Die Versuchsbeobachtung waren die Messwerte, die während des Versuchs ermittelt wurden. Sie sind in der unten stehenden Tabelle zu finden.
Auswertung:
Das pH-Meter zeigte bei der reinen Salzsäure einen pH-Wert von -0,44 an. Dieser Wert muss korrigiert werden. Dazu wird der richtige pH-Wert mit Hilfe des verbrauchten Volumens der Natriumhydroxidlösung berechnet. Es wird mit dem Volumen gerechnet, bei dem der senkrechte Sprung stattfindet: Bei 84,5ml Zugabe der Maßlösung findet der Sprung im pH-Wert satt. Daraus lässt sich eine ursprüngliche Salzsäurekonzentration zu 0,169 mol/l berechen.
Mit dieser Konzentration ergibt sich ein pH-Wert von 0,77 für die reine Salzsäure.
Die Messwerte des pH-Meters müssen also alle um 1,21 = 0,77 + 0,44 korrigiert werden. Mit den korrigierten Werten wird die Titrationskurve gezeichnet.
Messwerttabelle:
| V in ml | pH | pH korrigiert | V in ml | pH | pH korrigiert |
| 0 | -0.44 | 0.77 | 51 | 0.21 | 1.42 |
| 1 | -0.43 | 0.78 | 52 | 0.22 | 1.43 |
| 2 | -0.42 | 0.79 | 53 | 0.24 | 1.45 |
| 3 | -0.41 | 0.80 | 54 | 0.25 | 1.46 |
| 4 | -0.40 | 0.81 | 55 | 0.26 | 1.47 |
| 5 | -0.39 | 0.82 | 56 | 0.28 | 1.49 |
| 6 | -0.38 | 0.83 | 57 | 0.31 | 1.52 |
| 7 | -0.37 | 0.84 | 58 | 0.33 | 1.54 |
| 8 | -0.36 | 0.85 | 59 | 0.35 | 1.56 |
| 9 | -0.35 | 0.86 | 60 | 0.37 | 1.58 |
| 10 | -0.34 | 0.87 | 61 | 0.40 | 1.61 |
| 11 | -0.33 | 0.88 | 62 | 0.42 | 1.63 |
| 12 | -0.32 | 0.89 | 63 | 0.45 | 1.66 |
| 13 | -0.31 | 0.90 | 64 | 0.47 | 1.68 |
| 14 | -0.30 | 0.91 | 65 | 0.49 | 1.70 |
| 15 | -0.29 | 0.92 | 66 | 0.52 | 1.73 |
| 16 | -0.28 | 0.93 | 67 | 0.54 | 1.75 |
| 17 | -0.27 | 0.94 | 68 | 0.58 | 1.79 |
| 18 | -0.26 | 0.95 | 69 | 0.61 | 1.82 |
| 19 | -0.25 | 0.96 | 70 | 0.65 | 1.86 |
| 20 | -0.24 | 0.97 | 71 | 0.68 | 1.89 |
| 21 | -0.23 | 0.98 | 72 | 0.72 | 1.93 |
| 22 | -0.22 | 0.99 | 73 | 0.76 | 1.97 |
| 23 | -0.21 | 1.00 | 74 | 0.79 | 2.00 |
| 24 | -0.20 | 1.01 | 75 | 0.84 | 2.05 |
| 25 | -0.18 | 1.03 | 76 | 0.89 | 2.10 |
| 26 | -0.16 | 1.05 | 77 | 0.97 | 2.18 |
| 27 | -0.15 | 1.06 | 78 | 1.03 | 2.24 |
| 28 | -0.13 | 1.08 | 79 | 1.10 | 2.31 |
| 29 | -0.12 | 1.09 | 80 | 1.23 | 2.44 |
| 30 | -0.11 | 1.10 | 81 | 1.32 | 2.53 |
| 31 | -0.10 | 1.11 | 82 | 1.50 | 2.71 |
| 32 | -0.08 | 1.13 | 83 | 1.73 | 2.94 |
| 33 | -0.07 | 1.14 | 84 | 2.20 | 3.41 |
| 34 | -0.05 | 1.16 | 85 | 8.88 | 10.09 |
| 35 | -0.04 | 1.17 | 86 | 9.80 | 11.01 |
| 36 | -0.03 | 1.18 | 87 | 10.10 | 11.31 |
| 37 | -0.02 | 1.19 | 88 | 10.27 | 11.48 |
| 38 | 0.00 | 1.21 | 89 | 10.37 | 11.58 |
| 39 | 0.01 | 1.22 | 90 | 10.45 | 11.66 |
| 40 | 0.02 | 1.23 | 92 | 10.53 | 11.74 |
| 41 | 0.03 | 1.24 | 93 | 10.57 | 11.78 |
| 42 | 0.05 | 1.26 | 94 | 10.62 | 11.83 |
| 43 | 0.07 | 1.28 | 95 | 10.67 | 11.88 |
| 44 | 0.08 | 1.29 | 96 | 10.70 | 11.91 |
| 45 | 0.09 | 1.30 | 97 | 10.73 | 11.94 |
| 46 | 0.10 | 1.31 | 98 | 10.76 | 11.97 |
| 47 | 0.12 | 1.33 | 99 | 10.78 | 11.99 |
| 48 | 0.13 | 1.34 | 100 | 10.80 | 12.01 |
| 49 | 0.14 | 1.35 |
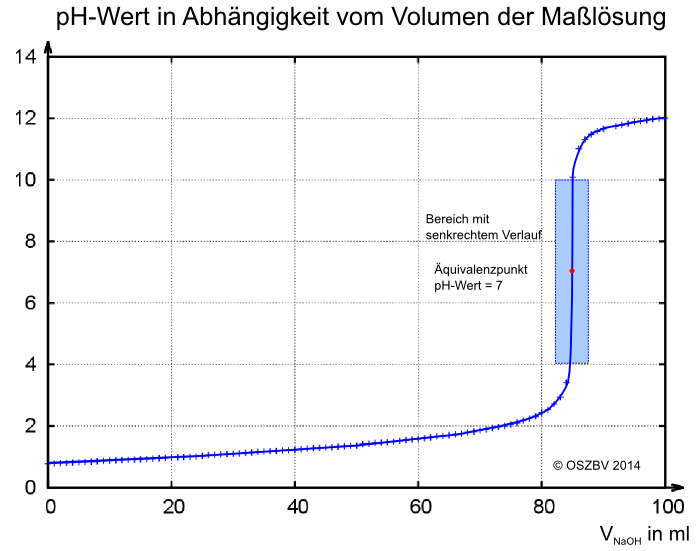
Der Äquivalenzpunkt ist der Wendepunkt der Kurve in dem senkrechten Kurvenbereich. Er liegt bei diesem Experiment, bei dem Salzsäure mit Natronlauge reagierte, genau bei dem pH-Wert 7. Für die Reaktion der starken Säure mit der starken Base ist das auch zu erwarten gewesen, denn die Salzsäure ist vollständig protolysiert und Natriumhydroxid ist ebenfalls vollständig dissoziiert. Das bedeutet, das bei gleicher Stoffmenge der beiden Reaktionspartner der pH-Wert 7 ist.
In der nächsten Stunde werden wir untersuchen, wo der Äquivalenzpunkt bei der Titration einer schwachen Säure, der Essigsäure liegt.