
Grenzen des Bohr'schen Atommodells
Problem der höheren Elemente
Leider konnte mit Hilfe des Bohr'schen Atommodells nur das Spektrum des
Wasserstoffatom exakt berechnet werden. Die höheren Elemente erforderten
neue Quantenzahlen:
l, m und s.
Mit ihnen konnten die höheren Spektren zwar prinzipiell erklärt aber nicht exakt
errechnet werden.
Heisenberg'sche Unschärferelation
Der Physiker Werner Heisenberg entdeckte 1926, dass man den Ort und die Geschwindigkeit von Teilchen nicht beliebig genau messen kann. Das bedeutete in letzter Konsequenz, dass es keinen Bahnen geben kann. Bei Bahnen wäre der Ort genau festgelegt und deshalb die Geschwindigkeit nicht mehr messbar. Das Modell von Bohr musste also komplett verändert werden.
Welle-Teilchen-Dualismus
Ein Laserstrahl wird auf ein Gitter (500 Linien/mm) gerichtet.
Wie wir in folgenden Bild sehen, gibt es ein Beugungsbild wenn man einen
Laser (Welle) auf ein Gitter schießt.
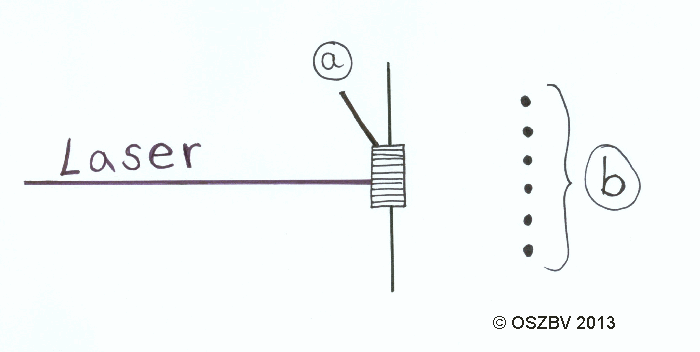
Legende
a = Gitter, b = Beugungsbild
Wenn man Elektronen auf ein noch feineres Gitter schießt ergibt sich auch ein Beugungsbild. Daher weiß man, dass sich Elektronen manchmal wie Wellen verhalten.
Der Physiker Louis de Broglie erklärte die Versuchsbeobachtung der Elektronenbeugung indem er der Materie eine Wellenlänge zuordnete. Nach folgender Formel lässt sich die Wellenlänge von Materie berechnen:
Für makroskopische Teilchen ergibt sich eine unmessbar kleine Wellenlänge, d.h. man kann die Wellneigenschaft der Materie nicht im Alltag beobachten. Für sehr kleine Teilchen mit sehr geringer Masse ist die Wellenlänge aber messbar und auch beobachtbar.
Im Bohr'schen Modell wird auch das nicht berücksichtigt. Weshalb ein ganz neuer Ansatz gewählt wurde.
Der Physiker Erwin Schrödinger konstruierte ein Atommodell, das auf stehenden Wellen basierte. Damit konnte man dann alle Eigenschaften der Atome erklären. Aus diesem Modell entwickelte sich dann das Orbitalmodell.
Erstellt von L.H. und Herrn Ecker. 28.8.2013