
Entropie
Die Entropie ist ein Maß für die Ordnung in einen System.
Je geringer die Ordnung ist, desto größer ist die Entropie.
Für die Berechnung der Entropie stellte Ludwig Boltzmann die folgende Formel
auf:
S = k ⋅ ln W
S ist darin die Entropie, k die Boltzmann-Konstante und W die Wahrscheinlichkeit für das
Auftreten des Zustandes in dem sich das System befindet.
Die Boltzmann-Konstante hat den Wert: k = 1,38 ⋅ 10 -23J/K
Hier fehlt noch ganz viel Text...!
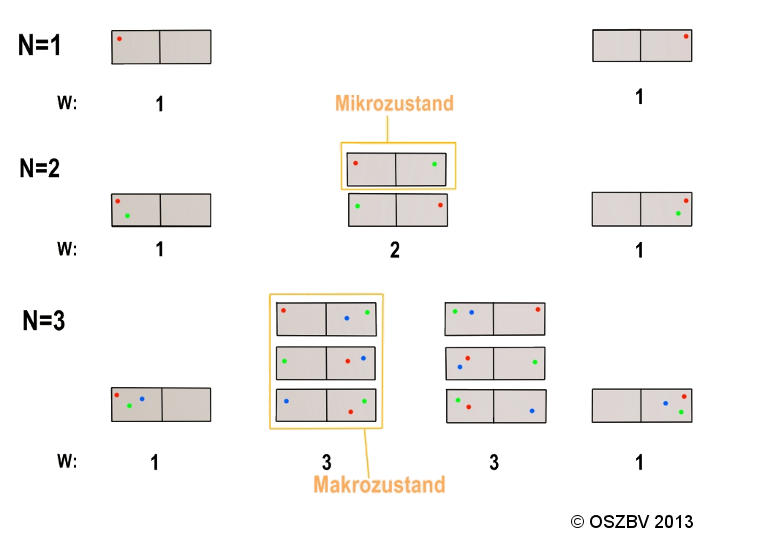
Wenn sich in einen stofflichen System 3 Teilchen befinden, dann ergeben sich 4 Makrozustände. Im ersten Makrozustand ( alle Teilchen befinden sich links) gibt es nur einen Mikrozustand. Der zweite Makrozustand ( 1 Teilchen links, 2 Teilchen rechts) enthält 3 Mikrozustände. Im dritten Makrozustand ( 2 Teilchen rechts, 1 Teilchen links) gibt es auch wieder 3 Mikrozustände. Und im letzten Makrozustand (alle Teilchen rechts) gibt es nur einen Mikrozustand. Ein System nimmt immer den Makrozustand ein, in dem die meisten Mikrozustände vorhanden sind.
Mit der Formel von Boltzmann kann man die Entropie nur sehr schwer direkt berechnen. Deshalb wählt man häufig einen anderen Weg:
Die Entropieänderungen während chemischer Reaktionen lassen sich auch mit Hilfe der molaren Standard-Entropien der Produkte und Edukte berechnen. Die Werte findet man in Tabellen. Es gilt folgende Formel für die Berechnung der molaren Standard-Reaktionsentropie:
Hier könnte eine Beispielrechnung aus der Hausaufgabe hin!